Глава 2. ТРАНСПОРТНЫЙ УЧАСТОК ГЕМОАРТЕРИАЛЬНОГО
РУСЛА СЕРДЦА
Артерии представляют собой
цилиндрические трубки с весьма сложным строением стенки. В стенке артерии
имеются 3 оболочки: внутренняя, средняя и наружная. В составе стенок крупных
сосудов преобладает межклеточное вещество в виде эластических волокон и
мембран. Подобные артерии являются сосудами эластического типа строения. В
стенках мелкого и отчасти среднего калибра преобладает гладкая мышечная ткань с
небольшим количеством межклеточного вещества. Такие артерии относят к мышечному
типу строения. В разных артериях степень развития эластической стромы выражена
неодинаково. Наиболее высокого развития она достигает в стенке аорты и
отходящих от нее артерий, имеющих эластический тип строения. В артериях
среднего и мелкого калибра в эластической строме остаются лишь внешние и
внутренние мембраны, при этом между слоями мышечных клеток находятся лишь
тонкие сети эластических волокон. В стенках самых мелких артерий и
прекапиллярных артериол эластическая строма совершенно теряется. Изменения
размеров артерий эластического типа происходят за счет механического растяжения
приложенным давлением. Сосуды мышечного типа изменяют свои размеры за счет механических
и биохимических факторов. Обменные микрососуды (артериолы и капилляры) своих
размеров практически не меняют ни при механическом, ни при биохимическом
воздействии на их стенки.
Гемоартериальный участок коронарного
русла следует разделить на последовательные генерации в зависимости от
особенностей устройства стенок артерий. В первые генерации входят артерии
эластического типа с диаметром более 500 мкм (ниже начинается реагирование
стенки на аденозин [Harder et al.,
1979]). В следующие генерации включаются артерии мышечного типа с
диаметром приблизительно от 500 до 100
мкм [Чернух и др., 1975; Мчедлишвили, 1989]. В завершающие генерации входят артериолы
с диаметром менее 100 мкм и капилляры (d=5-7 мкм). Первые две градации представляют
транспортный участок, по которому кровь перемещается без газообмена с окружающими
тканями. Обменные генерации представляют собою участок гемоартериального русла,
на котором кислород через стенки сосудов диффундирует в окружающие ткани.
Транспортный участок включает в себя генерации сосудов эластического и
мышечного типа. В нашу задачу входит осуществить раздельный математический анализ
этих генераций.
2.1.
Генерации сосудов эластического типа
Транспортный участок в целом можно
представить как совокупность последовательных генераций тройников –
артериальное "дерево" (рис. 6). Бифуркация является общим типом
разветвления коронарных артерий независимо от их диаметра, включая и артериолы
[Zamir, Chee, 1985].
![]()
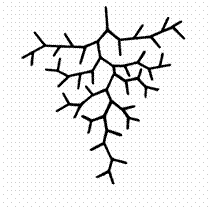
Отдельный тройник состоит из трех сопряженных
сосудов с движущейся кровью (ствол и две ветви). Тройник является системой, в
которую каждый из сосудов включен в качестве более "простой" системы.
Длина элемента тройника равна расстоянию по стволу от вершины угла предыдущего
разветвления, при котором образовался этот ствол, до вершины угла,
при котором он распался на ветви (рис. 7). Поскольку все сосуды в
тройнике принадлежат к эластическому типу, то такие тройники будем называть
"эластическими".
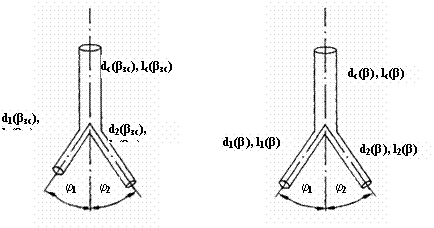
Рис. 7. Сосудистые
тройники. А – асимметричный тройник, Б – симметричный тройник. dС(βЗС), d1(βЗС), d2(βЗС), lС(βЗС), l1(βЗС), l2(βЗС) – соответственно диаметр и длина ствола и 1 и 2
ветвей, φ1(βЗС), φ2(βЗС) - углы отклонения 1 и 2 ветвей в золотом режиме гипертензии.
Установлено [Ross, 1967], что во всех коронарных артериях эластического
типа протекает пульсирующий кровоток. Анализ кривых кровотока показал [Цветков,
1993], что в каждом пульсирующем
сосуде (крупные, средние и мелкие артерии) средние за систолу (напряжение) и диастолу (расслабление) значения коронарного
кровотока приблизительно
равны друг другу. На пути перемещения крови к сердечным сосудам меньшего диаметра пульсации давления (а следовательно, и кровотока)
все более сглаживаются, в микрососудах с диаметром менее 100 мкм они
практически отсутствуют [Duling, Klitzman, 1980; Toyotaka
et al.,
1994]. С учетом равенства средних значений давления и кровотока за систолу и
диастолу, а также за кардиоцикл в целом, отпадает необходимость раздельного
анализа систолических и диастолических значений сердечных параметров (давление,
кровоток, проводимость,
объем и т.д.). Вследствие этого, в эластических тройниках мы не будем
рассматривать отдельно средние систолические и средние диастолические величины
параметров, а только их значения, усредненные за сердечный цикл.
Нашей задачей является показать
особенности архитектоники и гемодинамики эластических тройников сердца в
условиях физиологического покоя и физической нагрузки. Рост физической нагрузки
вызывает повышение среднего давления в аорте, т.е. возникает гипертензия. Режим
кровоснабжения здорового сердца млекопитающих в покое связан с пропорцией
золотого сечения и числами Фибоначчи и обозначен нами как золотой режим
гипертензии [Цветков, 1993, 1997]. У различных видов млекопитающих золотому
режиму гипертензии соответствует своя "золотая" частота сердцебиений nЗС. При
этой частоте соотношение длительностей систолы, диастолы и сердечного цикла
соответствует пропорции золотого сечения. При каждой фиксированной нагрузке
через 3-5 минут устанавливается стабильные величины сердечных параметров
(сердечный ритм, среднее давление в аорте, коронарный кровоток, потребление
кислорода миокардом и т.д.), соответствующие данному уровню гипертензии. Ранее
нами было показано [Цветков, 1993, 1997], что при физической нагрузке
относительные изменения многих сердечных параметров так или иначе связаны с
показателем уровня гипертензии
β = P(n)/P(nЗС) = Ön/nЗС,
где nЗС, n - частота сердцебиений, P(nЗС), P(n) – среднее давление в аорте в золотом и некотором режиме гипертензии.
Естественно, что в золотом режиме показатель роста гипертензии βЗС=β=1.
Максимальной гипертензии соответствует β=2 [Цветков, 1993]. В дальнейшем
при расчетах изменений сердечных параметров будем считать золотой режим
гипертензии исходным.
2.1.1. Архитектонические и гемодинамические параметров
эластических тройников в золотом режиме гипертензии
Конструкционные особенности всякого
тройника можно представить тремя коэффициентами:
1) коэффициент
ветвления
k(bЗС) = [S1(bЗС) + S2(bЗС)]/SС(bЗС) = [d1(bЗС)2 + d2(bЗС)2]/dС(bЗС)2 (2.1)
2) коэффициенты
относительного сечения ветвей
H1((bЗС) = S1(bЗС)/[S1(bЗС) + S2(bЗС)] = d1(bЗС)2/[d1(bЗС)2
+ d2(bЗС)2], (2.2)
H2(bЗС) =
S2(bЗС)/[S1(bЗС) + S2(bЗС)] = d2(bЗС)2/[d1(bЗС)2 + d2(bЗС)2], (2.3)
где SС(bЗС), S1(bЗС), S2(bЗС) - площади поперечных сечений ствола, 1 и 2 ветвей, dС(bЗС), d1(bЗС), d2(bЗС)dС(bЗС) – диаметры ствола и 1и 2 ветвей в золотом режиме
гипертензии.
Теоретически доказано [Шошенко и др.,
1982], что величинам 1<k£1,26 в тройниках соответствует оптимальный режим “минимальной работы”. В этой же работе авторами представлена экспериментальная зависимость k=f(H) для сердечных
сосудов, где k=1,10-1,20. Следовательно, движение крови в тройниках сердца в
покое имеет оптимальную основу. Исходя из соотношений в параграфе 1.3,
распределение кровотока в стволе и ветвях:
QС(bЗС) = a(bЗС)dc(bЗС)3,
Q1(bЗС) = a(bЗС)d1(bЗС)3,
Q2(bЗС)= a(bЗС)d2(bЗС)3,
где QС(bЗС), Q1(bЗС), Q2(bЗС) –
кровоток в стволе, 1 и 2 ветвях, dc(bЗС), d1(bЗС), d2(bЗС) –
диаметр ствола, 1 и 2 ветвей, a(bЗС) -
коэффициент оптимальной перфузии в золотом режиме гипертензии. Подобное
распределение кровотоков соответствует оптимальному соотношению диаметров в
тройнике [Розен, 1969]
d1(bЗС)3
+ d2(bЗС)3
= dС(bЗС)3. (2.4)
Для оценки взаимосвязи между длиной и диаметром сердечных сосудов введем дополнительный параметр
конструкции сосуда
C(bЗС)=l(bЗС)/d(bЗС),
где l(bЗС) –
длина сосуда в золотом режиме гипертензии. Рассмотрим соотношения между
диаметрами и длинами ствола и ветвей в некотором тройнике с привлечением
коэффициентов k(bЗС), H(bЗС) и C(bЗС). Связь
между ветвями и стволом может быть представлена следующими выражениями
[Цветков, 1993]:
d1(bЗС) =Ö[k(bЗС)(b)H1(bЗС)]dС(bЗС),
(2.5)
d 2(bЗС) =Ö[k(bЗС)H2(bЗС)]dС(bЗС), (2.6)
l 1(bЗС) = Ö[k(bЗС)H1(bЗС)][С1(bЗС)/СС(bЗС)]lС(bЗС),
(2.7)
l 2(bЗС) = Ö[k(bЗС)H2(bЗС)][С2(bЗС)/СС(bЗС)]lС(bЗС),
(2.8)
где СС(bЗС)=lС(bЗС)/dС(bЗС), С1(bЗС)=l1(bЗС)/d1(bЗС), С2(bЗС)=l2(bЗС)/d2(bЗС) -
коэффициенты конструкции сосудов тройника в золотом режиме гипертензии.
В соответствии с
(2.5) и (2.6) выражение (2.4) можно преобразовать,
[k(bЗС)(b)H1(bЗС)3/2 + k(bЗС)H2(bЗС)]3/2
= 1. (2.9)
К.А.Шошенко [Шошенко и др., 1982, с. 22]
показано, что распределение коэффициента конструкции по цепочке
сердечных сосудов аналогично и для млекопитающих, и для рыб. Для сердечных артериальных
сосудов с диаметрами более 40 мкм С(bЗС)=3
[Шошенко и др., 1982; Цветков, 1993]. Отметим, что эластические сосуды
превышают по диаметру 50 мкм. Следовательно, на этом участке отношения С1(bЗС)/СС(bЗС) =С2(bЗС)/СС(bЗС)=1. С
учетом этого обстоятельства покажем, что в покое для всех сосудов на
"эластическом" участке коэффициент оптимальной перфузии
a(bЗС)
одинаков. Для этого необходимо рассмотреть изменения ветвей по отношению к
стволу для параметров d(bЗС), l(bЗС) и t(bЗС),
входящих в a(bЗС).
Преобразования d(bЗС) и l(bЗС) для
ветвей представлены в (2.5)-(2.8). Время пребывания эритроцитов в сосуде
t(bЗС) = V(bЗС)/Q(bЗС).
В соответствии с (2.5)-(2.8) объемы
крови V в ветвях и стволе соотносятся следующим образом,
V1(bЗС) = (p/4)[d1(bЗС)]2l1(bЗС) = [k(bЗС)H1(bЗС)]3/2VС(bЗС), (2.10)
V2(bЗС) = (p/4)[d2(bЗС)]2l2(bЗС) =[(k(bЗС)H2(bЗС)]3/2VС(bЗС), (2.11)
где VС(bЗС), V1(bЗС), V2(bЗС) - объемы ствола и ветвей в золотом режиме. Очевидно,
что суммарный объем ветвей равен объему ствола,
V1(bЗС) + V2(bЗС) = VС(bЗС).
Кровотоки в стволе и ветвях в режиме “минимальной работы” связаны выражениями [Шошенко и
др., 1982]
Q1(bЗС) = [k (bЗС)H1(bЗС)]3/2QС(bЗС), (2.12)
Q2(bЗС)
= [k (bЗС)H2(bЗС)]3/2QС(bЗС), (2.13)
где QС(bЗС), Q 1(bЗС), Q2(bЗС) - кровотоки в стволе и ветвях в золотом режиме.
Исходя из
(2.10)-(2.11) и (2.12)-(2.13),
t1(bЗС) = V1(bЗС)/Q1(bЗС) = tC(bЗС), (2.14)
t 2(bЗС) = V2(bЗС)/Q2(bЗС) = tC(bЗС),
(2.15)
где tC(bЗС), t1(bЗС), t2(bЗС) -
время пребывания эритроцитов в стволе и ветвях в золотом режиме гипертензии.
Очевидно, что время пребывания эритроцитов в сосудах любого эластического
тройника независимо от их калибра одинаково: t1(bЗС) = t2(bЗС) = tС(bЗС). Как
будет показано ниже в параграфе 3.3 во всяком сосуде в любой
"эластической" j-генерации tj = 18,5 мсек. C учетом этих данных коэффициент перфузии для любого j-сосуда равен оптимальной величине
a J(bЗС) =
(π/4)l(bЗС)/d(bЗС)t(bЗС) = 127 c-1.
(2.16)
Для артерий в тройнике отношение h/d =const [Cohn, 1954,
1955; Kamiya, Togawa, 1972],
где d – диаметр, h –
толщина стенки сосуда. Исходя из этого,
VСТ1(bЗС) = [k(bЗС)H1(bЗС)]3/2VСТС(bЗС), (2.17)
VСТ2(bЗС) = [k(bЗС)H2(bЗС)]3/2VСТС(bЗС), (2.18)
где VСТС(bЗС), VСТ1(bЗС), VСТ2(bЗС) - объемы стенок ствола и ветвей. Очевидно, что
суммарный объем стенок ветвей равен объему стенки ствола,
VСТ1(bЗС) + VСТ2(bЗС) = VСТС(bЗС).
Очевидна
интересная особенность архитектоники эластических тройников – суммарный объем
сосудистой массы и суммарный объем крови в ветвях соответственно равны объему
сосудистого материала и объему крови в стволе. Ветви по этим параметрам как бы
"воспроизводят" ствол! Отметим,
что воспроизводство объемов крови и сосудистого материала имеет место при любой
степени асимметрии (1<k(bЗС)<1,26, H1(bЗС)≠H2(bЗС)). Показано [Kamiya, Togawa, 1972; Kamiya et al., 1974], что при заданном
кровотоке через тройник и заданном давлении между началом ствола и концами
ветвей именно в режиме «минимальной работы» общий объем крови в сосудах
тройника имеет минимальную величину. С другой стороны, Кон (Cohn, 1954, 1955) показал, что минимальный расход
сосудистого материала в тройнике имеет место при архитектонике тройника,
соответствующей режиму "минимальной работы". Таким образом, эластические тройники сердца пропускают
через себя кровоток с минимальными затратами крови и сосудистого материала.
Покажем, что давление, приложенное к
отдельному сосуду, постоянно для всех эластических генераций.
Давление, приложенное к стволу тройника,
DPC(bЗС) = QC(bЗС)/GC(bЗС),
где DPC(bЗС), GC(bЗС) -
соответственно давление, приложенное к стволу, и проводимость ствола в золотом
режиме гипертензии.
Проводимость ветвей тройника сосуда на
"эластическом" участке, где коэффициент конструкции сосуда С(bЗС) и
вязкость крови x(bЗС) постоянны, в
соответствии с (2.6)-(2.8)
G1(bЗС) = (p/128)[d 1(bЗС)]4/x1(bЗС)l1(bЗС) = [k(bЗС)H1(bЗС)]3/2GСbЗС), (2.19)
G2bЗС) = (p/128)[d2(bЗС)]4/x2(bЗС)l2(bЗС) = [k(bЗС)H2(bЗС)]3/2GС(bЗС). (2.20)
где GСbЗС), G1(bЗС), G2(bЗС) –
соответственно проводимость ствола, 1 и 2 ветвей в золотом режиме гипертензии.
Очевидно, что во всех тройниках по проводимости также имеет место
"воспроизводство" ствола ветвями,
G1(bЗС) + G2(bЗС)= GС(bЗС).
Поскольку кровоток и проводимость в
каждой ветви по отношению к стволу изменяются в одинаковой степени (в [k(bЗС)HJ(bЗС)]3/2
раз), то
DP1(bЗС)=DP2(bЗС) =DPС(bЗС).
Следовательно, в
любом "эластичном" j-сосуде
DPJ(bЗС) =
const.
В дальнейшем нами будет показано, что и
для "мышечных", и для обменных сосудов величина приложенного давления
будет той же, что и для "эластических". Давление, приложенное к всему
артериальному участку, равно разности давлений в аорте и на артериальном конце
капилляров. Это давление не может превышать 35 мм рт. ст., т.к. при этом
начинается отек тканей [БСЭ, 1973, т. 13, с. 1381]. Поскольку при максимальной
гипертензии (b=2) давление на артериальном конце не должно превышать этой величины,
то в покое давление на артериальном конце сердечного капилляра не должно
превышать 17,5 мм рт. ст.(см. параграф 4.2.1) В параграфе 4.10 нами показано,
что независимо от веса млекопитающих в пределах 0,1-100.000 кг
DPJ(bзс)»3,5 мм рт. ст.
В общем виде закон структурно-динамической композиции
любого j-сосуда тройника можно представить выражением
DPJ(bЗС)tJ(bЗС) = 32xJ(bЗС)[lJ(bЗС)/dJ(bЗС)]2. (2.21)
В золотом режиме гипертензии для эластических
сердечных сосудов (d>100 мкм) имеем lJ(bЗС))/dJ(bЗС)=3
[Шошенко и др., 1982], xJ(bЗС) =3×10-2 ×г ×см-1 с-1 [Haynes, 1960] и расчетные величины DPJ(bЗС)=3,5 мм
рт. ст.=465,5 г××см-2×с-2 и tJ(bЗС)=18,5×10-3 c. Подставив эти данные, полученные экспериментальным путем и в результате расчетов, в (2.21), убедимся, что расхождение между
левой и правой частями
этого равенства незначительно, что
указывает на достаточно точное определение расчетных величин DPJ(bЗС) и tJ(bЗС). В
этом выражении левая часть отображает динамические параметры, т.е. давление, приложенное к j-сосуду,
и время пребывания эритроцитов в j-сосуде. В правой части представлены структурные параметры - кажущаяся вязкость крови, длина и диаметр сосуда. Очевидна гибкость оптимального "подбора" размеров сосудов.
Если “подбором” диаметров обусловливается энергооптимальный характер движения
кровотока в сосудах и количество ветвлений до капилляров, то “подбор” длины
обеспечивает адекватную величину давления на каждом сосуде. Учитывая полную
аналогию архитектоники артериального участка сердца различных видов
млекопитающих [Каро и др., 1981], можно сказать, что оптимальный «подбор» величин d, l, t и x составляет основу энергетической оптимизации кровоснабжения
сердца млекопитающих.
Рассмотрим соотношение затрат
механической и химической энергий в ветвях и стволе - энергетическую основу
транспорта крови по цепочке артериальных сосудов. Во всяком
сосуде общий расход энергии за единицу времени (мощности)
складывается из потерь на перфузию и биопроцессы в крови.
Механическая, “перфузионная”, мощность в
стволе в золотом режиме гипертензии
WМС(bЗС) = 128QС(bЗС)2[xC(bЗС)lC(bЗС)]/pdC(bЗС)4,
«химическая” мощность в стволе
WХС(bЗС) = (p/4)bС(bЗС)[dС(bЗС)]2lС(bЗС),
где bС(bЗС)-
потребление "химической" энергии в единичном объеме
крови за единицу времени.
С учетом
(2.5)-(2.8), (2.12)-(2.13) в 1 и 2 ветвях
WМ1(bЗС) = [k(bЗС)H1(bзс)]3/2WМС(bЗС),
(2.22)
WМ2(bЗС) = [k(bЗС)H2(bзс)]3/2WМС(bЗС),
(2.23)
где WМ1(bЗС), WМ2(bЗС) -
механическая мощность в 1 и 2 ветвях в золотом режиме.
Исходя из (1.1), в j-сосуде
bJ(bЗС) = 64xJ(bЗС)[lJ(bЗС)/dJ(bЗС)tJ(bЗС)]2.
(2.24)
Поскольку во всех эластических
генерациях x(bЗС)=3 10-2
Пз и l(bЗС)/d(bЗС)t(bЗС)=162 с-1, очевидно, что величина b(bЗС) в
каждом j-сосуде постоянна,
bJ(bЗС) =
50.390 эрг см3 с-1.
С учетом этой
величины и исходя из (2,5)-(2.8)
WХ1(bЗС) = [k(bЗС)H1(bЗС)]3/2WXС(bЗС),
(2.25)
WХ2(bЗС) = [k(bЗС)H2(bЗС)]3/2WXС(bЗС),
(2.26)
Из выражений
(2.22)-(2.23) и (2.25)-(2.26) очевидно,
что
WМ1(bЗС)/WХ1(bЗС) = WМ2(bЗС)/WХ2(bЗС) = WМС(bЗС)/WXС(bЗС).
Исходя из выражений, соответствующих WМ(bЗС) и b(bЗС), легко
показать, что на эластическом участке для всякого сосуда соотношение механической
и химической энергии одинаково
[Цветков, 1993, 1997].
γ(bЗС) = WМ(bЗС)/WХ(bЗС) = 0,5. (2.27)
Исходя из (2.22), (2.26) и (2.27),
отношение общих затрат мощности в стволе и ветвях эластического тройника
[W1(bЗС)+ W2(bЗС)]/WС(bЗС) = 1. (2.28)
В
выражениях (2.9), (2.27) и (2.28) представлены инварианты энергетической
оптимальности эластических тройников. Именно они обусловливают оптимальное вхождение
параметров архитектоники и гемодинамики в систему "Генерации эластических
сосудов". В дальнейшем нами
будет показано, что отношения (2.9), (2.27) и (2.28) аналогичны также и для
мышечных и обменных тройников.
В заключение можно сказать, что «вхождение»
отдельных гемодинамических и архитектонических параметров в эластические
тройники всегда имеет оптимальный характер. Энергетическая оптимизация
вхождения обусловлена постоянными для всех тройников отношениями (2.9), (2.27)
и (2.28). С другой стороны, если проанализировать (2.10)-(2.11), (2.19-2.20),
(2.22-2.23) и (2.25-2.26), то нельзя не отметить еще один удивительный феномен
- суммарная проводимость ветвей, суммарный объем крови и суммарный расход
энергии в ветвях соответственно равны значениям этих параметров в стволе. Ветви
как бы «воспроизводят» ствол по веществу и энергии, т.е. имеет место
последовательное воспроизводство генераций! Каждая генерация сосудов «повторяет» предыдущую по затратам энергии и
живого вещества. В сущности, каждая генерация эквивалентна по этим
параметрам стволу первого эластического тройника. Однако при тех же затратах энергии, крови и
сосудистого материала каждая следующая
генерация имеет большую суммарную поверхность и протяженность сосудов, чем
предыдущая. Этот феномен имеет огромное значение для обменной части коронарного
русла. В конечном же счете, эластический отдел транспортного участка
«пропускает» через себя единичный объем кислорода с минимальными затратами
энергии, крови и сосудистого вещества.
2.1.2. Архитектонические и
гемодинамические параметры эластических тройников в режимах гипертензии
При переходе от покоя
к физической нагрузке среднее давление в аорте и средний коронарный кровоток
возрастают. При фиксированной величине физической нагрузки через 3-5 минут устанавливаются
стабильные значения давления, кровотока и других архитектонических и
гемодинамических параметров. Необходимо отметить, что при нагрузке во всех
крупных коронарных артериях наблюдаются аналогичные изменения.
Отмечена неизменность соотношений средних
кровотоков в ветвях левой коронарной артерии в покое и при различных уровнях физической нагрузки [Khouri et al. 1965, Vatner
et al.,
1972]. Соотношение средних кровотоков в эндо- и эпикардиальных слоях постоянно в покое и при любой мышечной нагрузке [Ball, Bache, 1976]. Не меняется и отношение среднего кровотока в коронарном синусе к общему среднему коронарному кровотоку [Lafontant et al., 1962] и среднему кровотоку
в левой коронарной артерии [Rayford
et al.,
1959] при изменении давления в аорте и сжатии легочной артерии. Представленные явления возможны лишь в том случае, если в каждом сосуде при гипертензии
средняя за систолу, средняя за диастолу и средняя за кардиоцикл величины
кровотока равны друг другу и при гипертензии изменяются в одинаковой степени.
Феномен равенства среднесистолического, среднедиастолического и среднего значений относится и
к другим гемодинамическим параметрам отдельного сосуда (давление, проводимость, объем и т.д.) [Цветков, 1993]. Вследствие этого можно
говорить об аналогичности относительных изменений
среднесистолического, среднедиастолического и среднего значений того или иного параметра при переходе на новый уровень гипертензии. Этот феномен позволяет нам не производить анализ рассматриваемых параметров раздельно для систолы, диастолы и сердечного
цикла. В дальнейшем при рассмотрении изменений какого-либо
параметра в условиях гипертензии мы будем использовать его среднее значение за
сердечный цикл.
Кровоснабжение сердца
обусловлено величиной среднего давления в аорте. По этой
причине в дальнейшем для анализа параметров архитектоники и
гемодинамики при гипертензии будем использовать коэффициент роста гипертензии b. Этот коэффициент связан с изменением среднего давления в аорте по отношению к золотому режиму,
b = P(b)/P(bЗС),
где P(bЗС), P(b) – среднее давление в аорте в золотом и некотором
режимах гипертензии. Для человека и млекопитающих в естественных пределах
вариации физической нагрузки (от покоя до максимальной
нагрузки) b=1-2 [Цветков, 1993]. В качестве исходного режима примем
золотой режим гипертензии (b=bЗС=1).
Мы можем перейти непосредственно к
анализу артериальных тройников эластического типа. В этих тройниках размеры
сосудов (длина и диаметр) изменяются за счет изменения приложенного давления.
Ниже нами будут рассмотрены иэменения параметров архитектоники и гемодинамики
тройников в условиях гипертензии. В режимах гипертензии среднее давление в
аорте P(b), общий коронарный кровоток Q(b) и время прохождения эритроцитами кровеносного русла
сердца t(b) изменяются следующим образом [Цветков, 1993, 1997],
P(b) = bP(bЗС),
Q(b) = b2Q(bЗС),
t(b) = t(bЗС)/b.
В
режимах гипертензии для любого сосуда j-генерации
ΔPJ(b) = bΔPJ(bЗС), (2.29)
QJ(b) = b2QJ(bЗС), (2.30)
tJ(b) = tJ(bЗС)/b. (2.31)
Исходя
из выражений (2.29)-(2.31),
VJ(b) = bVJ(bЗС),
GJ(b) = bGJ(bЗС),
где VJ(bЗС), VJ(b), GJ(bЗС), GJ(b) - соответственно объем и проводимость j-сосуда в золотом и других режимах гипертензии.
Эластические артерии
при гипертензии расширяются и удлиняются. Морфологически феномен одновременного
расширения и удлинения сосудов объясняется спиральным расположением мышечных
клеток в стенках сосудов [Куприянов, 1983]. Из анализа экспериментальных данных
[Valenta et al., 1994, c. 172] следует, что при увеличении давления в артериальном
сосуде его диаметр и длина изменяются в одинаковой степени,
d/d0 = l/l0 = (P/P0)1/3,
где P0, d0, l0, P, d, l – соответственно исходные величины давления, приложенного
к сосуду, диаметра и длины сосуда и их значения, соответствующие возросшему
артериальному давлению.
Очевидно, что при
гипертензии
dJ(b) = b1/3dJ(bЗС),
(2.32)
lJ(b) = b1/3lJ(bЗС),
(2.33)
где dJ(b), lJ(b) - соответственно диаметр и
длина j-сосуда в режиме гипертензии.
Оптимальную
структурно-динамическую композицию любого j-сосуда в
некотором режиме гипертензии можно представить выражением
bDPJ(bЗС)tJ(bЗС)/b = 32xJ(bЗС)[b1/3lJ(bЗС)/b1/3dJ(bЗС)]2.
(2.34)
В данном выражении xJ(b)=xJ(bЗС),
поскольку при гипертензии в пределах изменения калибра сосудов вязкость крови
на всем транспортном участке не меняется. В законе (2.34) отображены
относительные изменения структурно-динамических параметров, представляющих
расход механической энергии в сосудах транспортного участка.
Исходя из (2.32),
можно показать, что k(b) = k(bЗС), H1(b) = H1(bЗС), H2(b) = H2(bЗС). Таким
образом, во всех режимах гипертензии условия энергетической оптимальности
сохраняются (см. (2.4) и (2.9)),
[b1/3d1(bЗС)]3
+ [b1/3d2(bЗС)]3
= [b1/3dС(bЗС)]3, (2.35)
[k(b)H1(b)]3/2 + [k(b)H2(b)]3/2
= 1. (2.36)
Рассмотрим раздельно
изменения механической и химической мощности в условиях гипертензии.
Механическая
мощность в стволе и ветвях с учетом (2.30), (2.32) и (2.33)
WМС(b) = b3WМС(bЗС),
(2.37)
WМ1(b) = b3[k(bЗС)H1(bЗС)]3/2WМС(bЗС), (2.38)
WМ2(b) = b3[k(bЗС)H2(bЗС)]3/2WМС(bЗС), (2.39)
В соответствии с (2.24) и
(2.31)-(2.33)
bJ(b) = b2bJ(bЗС)
(2.40)
Соответственно, химическая мощность в
стволе и ветвях с учетом (2.32), (2.33) и (2.40)
WХС(b) = b3WХС(bЗС), (2.41)
WХ1(b) = b3[k(bЗС)H1(bЗС)]3/2WХС(bЗС),
(2.42)
WХ2(b) = b3[k(bЗС)H2(bЗС)]3/2WХС(bЗС).
(2.43)
При анализе
(2.36)-(2.39) и (2.41)-(2.43) для тройника очевидна полная аналогия
относительных изменений "механических" и "химических" мощностей
при переходе от золотого режима к гипертензии. Как следствие этого, в каждом j-сосуде, как и в золотом режиме, сохраняется отношение
WМJ(b)/WХJ(b) = WМJ(bЗС)/WХJ(bЗС) = 0.5.
(2.44)
Отметим, что отношение
общих затрат мощности в стволе и ветвях при гипертензии то же, что и в золотом
режиме,
WС(b)/[W1(b) + W2(b)] = 1. (2.45)
В заключение можно
сказать, что имеет место полная аналогия
отношений (2.4), (2.9), (2.27) и (2.28) для покоя и (2.35), (2.36), (2.44) и
(2.45) для гипертензии. Эти отношения составляют основу оптимального
"вхождения" параметров архитектоники и гемодинамики в систему
"Эластический тройник". "Присутствие" инвариантных отношений
обусловливает энергетическую оптимизацию "эластического" участка как
в покое, так и при физической нагрузке.
2.2. Генерации сосудов мышечного типа
2.2.1. Особенности регуляции размеров
мышечных сосудов
Качественная сторона
изменений архитектоники тех или иных параметров коронарного русла,
соответствующих гипертензии, в настоящее время достаточно хорошо изучена.
Однако структура изменений размеров сосудов в мышечных генерациях до сих пор
математически не обоснована. Ниже нами выдвигается гипотеза регуляции размеров
сосудов в каждой генерации и предлагаются математические структуры таких
изменений.
Около 70%
сопротивления коронарного русла контролируется мышечными микрососудами с
диаметром менее 200 мкм [Chillian
et al.,
1990]. Существуют три механизма регуляции диаметра коронарных мышечных сосудов:
1) метаболический, 2) миогенный и 3) эндогенный [Liao, Kuo, 1997].
Первый механизм увеличения диаметра связан с выделением аденозина из
кардиомиоцитов в ответ на возросшее потребление кислорода [Feigl, 1983]. Второй механизм обеспечивает расширение
сосуда в ответ на понижение давления в его просвете или, наоборот, его сужение
при повышенном давлении [McHale
et al.,
1987; Kuo et al., 1992]. Tретий механизм связан с изменением напряжения сдвига в
стенке сосуда; при этом происходит выделение вазодилятаторов из эндотелия [Holtz et al., 1984; Kuo et al., 1991]. Расширение кровеносных
сосудов в ответ на увеличения напряжения сдвига (или увеличения коронарного
кровотока) называют кровотоковой дилятацией.
Рассмотрим первый тип
регуляции. Роль аденозина в регуляции коронарного кровотока установлена еще в
60-70-х годах прошлого столетия. Было установлено, что содержание аденозина в
межклеточной жидкости является необходимым условием адекватного кровоснабжения
здорового сердца [Rubio, Berne, 1969; Freud, Laarse, 1977; Berne, 1980].
Было показано [Rubio, Berne, 1969; Olsson, 1970; Olsson et al., 1976], что аденозин легко
проходит через мембрану кардиомиоцита в межклеточное пространство и вызывает
расслабление мышечных клеток в стенках коронарных артерий. Образование
аденозина и его выход в межклеточное пространство происходит в ответ на
кислородное голодание клеток. При окклюзии коронарной артерии уже через 5 сек
уровень аденозина в миокарде возрастает почти в 3 раза [Olsson, 1970]. Концентрация аденозина и его производных в
течение систолы значительно выше, чем в диастоле [Thompson et al., 1980]. Отмечено воздействие
аденозина на стенки коронарных артерий вплоть до d=500 мкм [Harder et al., 1979]. Установлено [Kuo et al., 1995], что изолированные коронарные артерии (d=30-200 мкм) расширяются в ответ на воздействие
аденозина в различной степени; воздействие аденозина постепенно снижается с
увеличением размеров сосудов [Gellai
et al.,
1973]. На интактном сердце было показано, что аденозин воздействует в наиболее
значительной степени на микрососуды с диаметром менее 150 мкм [Kanatsuka et al., 1989; Jones et al., 1995].
Установлено [Watkinson et al., 1979; Saito et al., 1980; McKenzie et al., 1980; Ely et al., 1983; Matsunaga et al., 1996], что в условиях
гипертензии, вызванной физической нагрузкой, существует прямая зависимость
между ростом потребления кислорода миокардом и последующим увеличением
концентрации аденозина и проводимости коронарного русла. Механизм адекватного
соответствия работает в следующей последовательности. Физическая нагрузка
вызывает рост среднего давления в аорте (гипертензию), возрастание силы
сокращений миокарда и потребления последним кислорода. Требуется перестройка
коронарного кровообращения адекватно возросшему уровню потребления кислорода.
Вследствие временного дефицита кислорода в межклеточное пространство из
кардиомиоцитов выделяется дополнительный объем аденозина. Возросшая
концентрация аденозина и его производных обеспечивает расслабление мышечных
клеток в стенках сосудов в "нижних" генерациях мышечных сосудов (d<150 мкм). (Отметим кстати, что кротоковая
дилятация наиболее выражена в микрососудах с диаметром более 150 мкм [Liao, Kuo, 1997].)
После этого в верхних генерациях (d>150
мкм) снижается давление, возрастает кровоток, за счет чего увеличивается
напряжение сдвига в этих сосудах [Liao, Kuo, 1997]; при этом происходит выделение вазодилятаторов
из эндотелия, вызывающих расслабление мышечной стенки этих сосудов [Kuo et al., 1991]. Такая последовательность
вызывает дополнительный рост кровотока в верхних и нижних генерациях, что
увеличивает транспорт кислорода и снижает его дефицит в клетках. Как следствие,
снижается концентрация аденозина в межклеточной жидкости и на стенках сосудов.
Действие механизма сопряжения нижних и верхних генераций продолжается до тех
пор, пока дефицит кислорода не будет полностью устранен; при этом размеры
сосудов и кровотоки в сосудах устанавливаются на уровне, адекватном уровню
гипертензии.
По-видимому, одним из
факторов, ограничивающим увеличение просвета "верхних" сосудов,
является напряжение сдвига на их стенке. Показано [Zamir, 1977], что в оптимальном режиме "минимальной
работы" напряжение сдвига имеет постоянное значение независимо от калибра
сосуда,
τ=8ξс/d = 8ξl/dt,
где τ – напряжение сдвига на
стенке, ξ – вязкость крови, с – линейная скорость эритроцитов в сосуде, d, l – диаметр и
длина сосуда. Несложно показать в соответствии с (2.16), что для любого j–сосуда в золотом режиме гипертензии
τJ(bЗС) = 8ξJ(bЗС)lJ(bЗС)/dJ(bЗС)tJ(bЗС)=const.
Соответственно, в режимах
гипертензии
τJ(b) = bτJ(bЗС).
Высказано предположение [Шошенко и
др., 1982], что рост просвета сосуда прекращается, когда достигается
необходимое соотношение между
диаметром d и скоростью движения эритроцитов в сосуде. В
частности, установлено [Nakache, Peronneau, 1979], что каталитическая активность фермента b-галактозидазы на внутренней стенке меняется с
изменением скорости протекания жидкости. В каждом режиме гипертензии устанавливается
новое, оптимальное соотношение между скоростью и диаметром j-сосуда; это соотношение одинаково для всех сосудов.
При переходе к большей или меньшей гипертензии концентрация аденозина и других
вазодиляторных агентов, а также кровоток в "нижних", и
"верхних" микрососудах, соответственно возрастают или уменьшаются вплоть
до полного соответствия между количеством доставляемого и потребляемого кислорода.
Миогенная регуляция
проявляется, по-видимому, в тех случаях, когда напряжение в аорте выше или ниже
нормальной величины. В первом случае за счет этого вида регуляции падение
давления на резистивных генерациях возрастает, а во втором, наоборот, падает. В
итоге на генерациях обменных микрососудов устанавливается величина давления,
оптимальная для нормального, адекватного обеспечения кислородом сердечной
мышцы. Этот механизм имеет огромное значение для компенсации отклонений
давления в аорте от нормы. С другой стороны, показано [Liao, Kuo, 1997], что
в норме реакция миогенного механизма регуляции в ответ на возрастание
концентрации аденозина незначительна.
Необходимо отметить
еще одно важное обстоятельство: толщина мышечной массы в стенках генерации
артериальных микрососудов одинакового калибра различна [Аветисян, 1982].
Напряжение в мышечном слое определяется действием механизмов нейро-гуморальной
регуляции. Очевидно, что реакция сосудов одинакового диаметра, но с разной
толщиной мышечного слоя, будет различной при одной и той же концентрации аденозина
и эндотелиальных вазодилятаторов. Таким образом, для совокупности генераций
мышечных сосудов существуют два основных фактора регуляции:
1) различная реакция
сосудов возрастающего калибра на концентрацию аденозина и эндотелиальных
вазодилятаторов и
2) различие в толщине
мышечного слоя стенках сосудов одной и той же генерации, что позволяет
избирательно изменять размеры в пределах изменения "своего" давления
и "своей" концентрации вазодилятаторов.
В этих условиях распределение
сосудов по толщине их стенки должно приводить к определенному распределению по
критической концентрации аденозина на стенке и приложенному давлению. Следствием
этих механизмов является то, что каждый сосуд изменяет свои размеры в пределах
"своего" давления и "своих концентраций аденозина и
эндотелиальных вазодилятаторов. После превышения этих пределов сосуд перестает
удлиняться и расширяться. Естественно, что чем ниже калибр микрососуда, тем при
меньшем давлении и меньших концентрациях вазодилятаторов он перестает
увеличивать свои размеры.
2.2.2. Структуры архитектонических и гемодинамических
параметров генераций сосудов мышечного типа в режимах гипертензии
При гипертензии в генерациях
эластического типа размеры сосудов изменяются за счет "механического"
растяжения давлением (см. (2.32) и (2.33)). На "эластическом" участке
увеличение общей проводимости и объема каждой генерации происходит за счет
аналогичного увеличения размеров всех сосудов во всех генерациях. В генерациях
мышечного типа, приблизительно соответствущих коронарным артериолам с диаметром
от 500 до 100 мкм, изменение размеров не одинаково и в разной степени связано с
величиной приложенного давления и с концентрацией вазодиляторного агента
аденозина на мышечной стенке этих сосудов.
Архитектоника "мышечных"
тройников в золотом режиме гипертензии в своей основе аналогична архитектонике
"эластических" тройников. Аналогия заключается в том, что эти
тройники, как и в эластических генерациях, симметричны, а коэффициенты
конструкции одинаковы: (С(bЗС) =l1(bЗС)/d1(bЗС) = l2(bЗС)/d2(bЗС)= lС(bЗС)/dС(bЗС)=3).
Можно произвести анализ параметров архитектоники и гемодинамики мышечных
тройников в золотом режиме гипертензии и в итоге получить те же соотношения,
что и для эластических генераций. Однако в режимах гипертензии эти соотношения
у мышечных и эластических тройников будут разными. Рассмотрим архитектонику и
гемодинамику мышечных генераций и связь между ними в условиях гипертензии.
Если при гипертензии давление в аорте
увеличивается в b раз,
P(b) = bP(bЗС), (2.46)
то общий коронарный кровоток по
отношению к покою возрастает в b2 раз [Цветков, 1981, 1993],
Q(b) = b2Q(bЗС) (2.47).
Исходя из этих изменений, общая
проводимость коронарного русла при гипертензии возрастает в b раз,
G(b) = b2Q(bЗС)/bP(bЗС)=bG(bЗС).
(2.48)
Время прохождения
эритроцитов по сердечному сосудистому руслу в условиях гипертензии уменьшается
в b раз [Bernstein et al., 1962, Цветков, 1993],
t(b) = t(bЗС)/b. (2.49)
Следовательно,
общий объем коронарного русла увеличивается в b раз,
V(b) = b2Q(bЗС)t(bЗС)/b = bV(bЗС) (2.50)
Естественно предположить, что
одинаковые изменения суммарной проводимости и суммарного объема всего
коронарного русла возможны только при аналогичных изменениях этих параметров во
всех генерациях "эластических", "мышечных" и обменных
сосудов. Такое предположение подтверждается большим количеством
экспериментальных данных. В частности показано [Khouri et al., 1965, Vatner et al., 1972], что соотношения кровотоков в ветвях левой коронарной артерии
остаются неизменными в покое и при различных уровнях
физической нагрузки. Соотношение кровотоков в покое и при любой
мышечной нагрузке постоянно также и в эндо- и эпикардиальных слоях миокарда [Ball, Bache, 1976]. Не
меняется отношение кровотока в коронарном синусе к общему
коронарному кровотоку [Lafontant et al., 1962] и кровотоку в левой коронарной артерии при изменении
давления в аорте и сжатии легочной артерии [Rayford et al., 1959]. Представленные выше
феномены возможны
лишь в том случае, когда кровотоки во всех генерациях артерий, артериол,
капилляров, венул и вен коронарного русла изменяются в одной и той же степени
- в b2 раз.
Очевидно, что для всякой j-генерации коронарных сосудов любого типа
Qj(b) = b2Qj(bЗС). (2.51)
где Qj(bЗС), Qj(b), – общий кровоток в j-генерации в
покое (золотой режим гипертензии) и некотором режиме гипертензии.
Экспериментально
установлена линейная зависимость между изменениями давления в аорте и сосудах
различных органов млекопитающих [Duling, 1980].
Следовательно, при возрастании давления в аорте в b раз, давление на j-генерации
∆Pj(b) = b∆Pj(bЗС) (2.52),
Поскольку в условиях
гипертензии для мышечных j-сосудов, как и
для эластических b1/3lJ(bЗС)/b1/3dJ(bЗС)=3 и ξ(b)=ξ(bЗС), то
исходя из (2.34), (2.51) и (2.52),
Gj(b) = bGj(bЗС),.
(2.53)
Vj(b) = bVj(bЗС),
(2.54)
tj(b) = tj(bЗС)/b.
(2.55)
где ∆Pj(bЗС), ∆Pj(b), Vj(bЗС), Vj(b), Gj(bЗС) Gj(b), tj(bЗС), tj(b) – соответственно давление,
приложенное к j-генерации мышечных сосудов,
проводимость, объем и время пребывания эритроцитов в золотом и других режимах
гипертензии.
Таким образом, относительные изменения общего
кровотока, общей проводимости, общего объема и времени пребывания в каждой
генерации эластических и мышечных сосудов аналогичны.
Общий коронарный
кровоток (см. 2.47) можно представить как сумму двух составляющих
b2Q(bЗС) = bQ(bЗС) + r(b)Q(bЗС),
где bQ(bЗС) –
часть общего кровотока при гипертензии, которая протекала бы через коронарное
русло при сохранении исходных, "золотых" размеров сосудов. Приращение
кровотока r(b)Q(bЗС) = b(b-1)Q(bЗС)
обеспечивается за счет изменения размеров сосудов в условиях гипертензии.
Структура общего
кровотока для j–генерации может быть представлена следующим образом,
b2Qj(bЗС) = bQj(bЗС) + b(b-1)Qj(bЗС).
(2.56)
Как и для кровотока, в соответствии с
(2.48) и (2.49), при гипертензии величины объема Vj(b) и проводимости Gj(b) можно представить в качестве
суммы двух составляющих,
bGj(bЗС) = Gj(bЗС) + x(b)Gj(bЗС),
bVj(bЗС) = Vj(bЗС) + x(b)Vj(bЗС),
где Gj(bЗС), Vj(bЗС), - общая проводимость и общий объем j-генерации в золотом режиме гипертензии. Приращения к
основной части проводимости и объема за счет: увеличения размеров сосудов в
условиях гипертензии
х(b)Gj(bЗС)= (b-1)Gj(bЗС),
х(b)Vj(bЗС)= (b-1)Vj(bЗС),
Следовательно, структуру этих параметров для j-генерации можно представить выражениями
bVJ(bЗС) = VJ(bЗС) + (b-1)VJ(bЗС),
(2.57)
bGJ(bЗС) = GJ(bЗС) + (b-1)GJ(bЗС).
(2.58)
В выражениях
(2.56)-(2.58) представлены структуры общего коронарного кровотока, общего
объема и общей проводимости для любой j-генерации
мышечных сосудов в режимах гипертензии. Благодаря этим структурам мы можем
каждый из этих параметров мысленно разделить на две части. Первая соответствует
ситуации, когда при гипертензии сохраняются "золотые" размеры всех
сосудов, а вторая соответствует приращению параметра за счет изменения размеров
сосудов в данном режиме гипертензии. Исходя из этих предпосылок, мы можем в
дальнейшем перейти непосредственно к анализу сопряжения мышечных тройников в
условиях гипертензии.
2.2.3. Особенности сопряжения генераций мышечных
сосудов в условиях гипертензии
Транспортный участок
сердца условно можно разделить на генерации двух типов. В генерациях первого,
эластического типа размеры сосудов при гипертензии изменяются за счет их
"механического" растяжения давлением (см. (2.32) и (2.33)). В
генерациях второго, мышечного типа изменения размеров обусловлены и давлением,
и воздействием вазодилятаторов.
Генерации,
соответствующие эластическому типу, рассмотрены нами выше в 2.2.2. В этих
генерациях все сосуды изменяют свои размеры аналогично по законам
(2.32)-(2.33). Эластические тройники можно считать "подобными",
поскольку у них при гипертензии каждый из параметров ствола и ветвей
изменяются в равной степени
("подобно") (рис. 8).
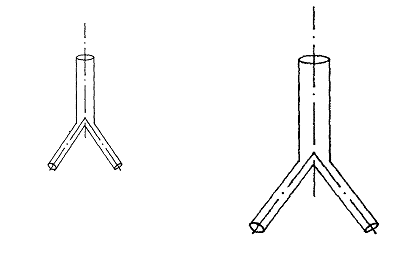 Рис. 8. Эластические
симметричные тройники.
Рис. 8. Эластические
симметричные тройники.
А
– тройник в золотом режиме, Б – тройник
в режиме гипертензии. d1(β)=β1/3d1(βзс)=0,794β1/3dС(βЗС), d2(β) = β1/3d2(βЗС) = 0,794β1/3dС(βЗС), dС(β)=β1/3dС(βЗС), l1(β)=β1/3l1(βЗС)=0,794β1/3lС(βЗС), l2(β)=β1/3l1(βЗС)= 0,794β1/3lС(βЗС), lС(β)= β1/3lС(βЗС).
Аденозин не оказывает
воздействия на стенки этих сосудов. В генерациях мышечного типа стенки
сердечных сосудов реагируют расслаблением на увеличение концентрации аденозина
в межклеточной жидкости и эндотелиальных вазодилятаторов. В тройниках второго,
мышечного типа ствол и ветви имеют разную чувствительность не только к
изменению давления, но и к концентрации вазодиляторных агентов. Такие тройники
следует обозначить "переходными",
поскольку в них представлено сопряжение двух соседних генераций с различными
условиями изменения размеров сосудов. В этих тройниках параметры ствола и
ветвей при гипертензии изменяют свои размеры по различным законам.
Нам представляется
наиболее вероятным следующий механизм регуляции размеров сосудов в мышечных
тройниках. Для удобства анализа сопряжения мышечных генераций введем
обозначение - "сквозная цепочка сосудов". В нашем случае это цепочка
последовательно соединенных мышечных сосудов приблизительно от 500 до 100 мкм.
От этой цепочки по мере продвижения к капиллярам отходят все более короткие
цепочки сосудов; обозначим их "боковыми". Рассмотрим изменения
размеров артерий в сквозной и боковых цепочках в ответ на изменение давления и
концентрации вазодилятаторов.
Начнем перемещаться по сквозной цепочке
в направлении - от мелких звеньев к более крупным. Мысленно в исходном, золотом
режиме гипертензии "окрасим" всю сквозную цепочку красным цветом.
Естественно этим же цветом будут окрашены и все боковые цепочки. В дальнейшем
по мере возрастания гипертензии для окраски части звеньев цепочки будем
последовательно пользоваться другими цветами (оранжевым, желтым, зеленым,
голубым и т.д.). При начальном превышении золотого режима в некотором диапазоне
βЗС<β≤β1 все сосуды сквозной
цепочки "выше" определенного количества начальных звеньев начинают
"оранжеветь" (за исключением первых звеньев). Первые звенья и
отходящие на этом участке боковые цепочки сохраняют красный "цвет",
соответствующий золотому режиму. Это означает, что эти сосуды сохранили размеры
золотого режима. Выше последнего "красного" звена остальная часть
сквозной и все оставшиеся боковые цепочки окрашиваются в "оранжевый"
цвет (в каждой генерации одинаковых сосудов происходит перекрашивание части
"красных" сосудов в оранжевый цвет). Теперь всякая j-генерация сосудов одинакового калибра будет окрашена
в два цвета: красный и оранжевый. "Оранжевые" сосуды увеличиваются в
размерах в соответствии с (2.32) и (2.33). В следующем диапазоне гипертензии
β1<β≤β2 при превышении уровня
β1 звенья сквозной цепочки будут "желтеть" (за
исключением расположенных ниже "красных" и "оранжевых"
звеньев и "их" боковых цепочек). Всякая j-генерация сосудов исходно одинакового калибра теперь
будет "окрашена" в красный, оранжевый и желтый "цвета"
(произошло перекрашивание части оранжевых сосудов в желтый цвет).
"Желтые" сосуды увеличиваются в размерах соответственно величине
гипертензии (см. (2.32) - (2.33)). В диапазоне β2<β≤β3
звенья сквозной и боковые цепочки "зеленеют" за исключением
расположенных ниже "красных", "оранжевых" и
"желтых" звеньев и их боковых цепочек. При достижении гипертезии
β3 каждая j-генерация
исходно одинаковых сосудов будет окрашена в четыре "цвета": красный,
оранжевый, желтый и зеленый (при этом происходит перекрашивание части
"желтых" сосудов в зеленый цвет). Подобное "окрашивание"
можно продолжать вплоть до максимальной гипертензии (β=2). В итоге j-генерация сосудов одинакового исходного калибра будет
окрашена "во все цвета радуги". Размеры одинаково окрашенных сосудов
"законсервированы" на уровне соответствующего им диапазона гипертензии.
Исходя из (2.32) и (2.33), очевидно, что в каждой генерации "зеленые"
сосуды превосходят по размерам "желтые", а "желтые", в свою
очередь, больше "оранжевых" и т.д. Естественно, что размеры последней
"расцветки" сосудов будут наибольшими, т.к. они соответствуют
максимальной гипертензии. Можно сказать, что в каждой j-генерации представлены сосуды всех размеров,
соответствующих режимам гипертензии от золотого до реально существующего.
При росте гипертензии до максимума звенья
сквозной цепочки окрашены в различные "цвета" максимальной
насыщенности. Размеры и "цвета" сквозных сосудов соответствуют
граничным значениям диапазонов гипертензии βЗС, β1,
β2, β3,…βn,…βmax;
эти величины можно рассчитать по формулам (2.32) и (2.33). Каким же образом
реализуется изменение интенсивности "окраски" внутри каждого
диапазона гипертензии? Ответ очевиден: за счет изменений "внутри"
боковых цепочек. Каждая боковая цепочка имеет "свой" поддиапазон
гипертензии (βЗС>β≤β1, β1>β≤β2,
β2>β≤β3 и т.д.). Для этого
поддиапазона она является "сквозной". Естественно, что и у нее есть
свои "боковые" цепочки. При росте гипертезии в пределах диапазона,
например βЗС>β≤β1, происходит
полная аналогия процедуры "окрашивания", как это имеет место на
сквозной цепочке (эта процедура теперь относится только к одному оранжевому
"цвету"). Происходит дробление "оранжевого" диапазона на
мелкие поддиапазоны. Соответственно, в j-генерации "оранжевая" фракция сосудов
расслаивается на "оттенки" от минимальной до максимальной
насыщенности. Каждый из "оттенков" соответствует "своей"
части сосудов с размерами, соответствующими "своему" поддиапазону в
пределах βЗС>β≤β1. Таким образом
происходит плавное изменение количества и размеров сосудов в
"оранжевом" диапазоне. В аналогичной последовательности происходит
дробление цвета в "желтом", "зеленом" и других
"цветовых" диапазонах. Как следствие такого дробления, каждая j-генерация сосудов исходно одинакового калибра
оказывается плавно окрашенной "во все цвета радуги". Размеры каждого
сосуда по "цвету" и интенсивности окраски соответствуют той или иной
величине гипертензии.
В соответствии с (2.57) и (2.58), при
определенном уровне гипертензии объем и проводимость каждой эластической и мышечной генерации увеличивается в одной и той же
степени. При любом уровне гипертензии обеспечивается равенство всех
мышечных генераций по давлению, кровотоку, объему и проводимости независимо от
их калибра. "Мозаика" размеров
в структурах различных генераций не нарушает оптимальное сопряжение последних при
любом уровне гипертензии и, в конечном счете, обеспечивает оптимальное
"вхождение" в систему "Мышечные генерации".
В обменных генерациях размеры сосудов
остаются постоянными при любой гипертензии. Поэтому изменения кровотока, объема
и проводимости в этих генерациях происходят только за счет вновь открытых
артериол и капилляров. Естественно, что вновь открытые микрососуды также
"окрашиваются" в разные цвета, что указывает на принадлежность
каждого из них к "своей" величине гипертензии. В режимах гипертензии
в обменных генерациях соотношения параметров гемодинамики между "окрашенными"
сосудами те же самые, что и для мышечных генераций.
2.2.4. Переходные тройники в режимах гипертензии
Транспортные эластические тройники в условиях
гипертензии рассмотрены нами выше в параграфе 2.1.2. В этом варианте и ствол и
обе ветви изменяют свои размеры аналогично по законам (2.32)-(2.33) (см. рис.
7). Перейдем к непосредственному анализу переходных мышечных тройников, у
которых при гипертензии размеры ствола и каждой из ветвей изменяются по
различным законам (рис. 9).
Такие тройники мы обозначили "переходными". Ствол и одна из ветвей
переходного тройника являются звеньями сквозной цепочки; другая ветвь является
первым звеном боковой цепочки.
Три составляющих каждого параметра в структурах
(2.56)-(2.58) можно "перенести" на переходной тройник. Левая часть
этих равенств соответствует стволу, первый элемент правой части
("сквозной") - 1 ветви и второй элемент ("боковой") – 2
ветви. Первую ветвь можно было бы обозначить "сквозной", а вторую -
"боковой". Однако для удобства в дальнейшем будем обозначать
"сквозную" и "боковую" соответственно как 1 и 2 ветви.
Рассмотрим в качестве примера законы
изменения архитектоники и гемодинамики переходного тройника в некотором
диапазоне гипертензии bn-1<b£bn.
В пределах этого диапазона диаметр и длина ствола изменяются подобно
эластическому сосуду, т.е. в соответствии с (2.32) и (2.33). Размеры 1 ветви
"законсервированы" на уровне, достигнутом на верхней границе
предыдущего диапазона bn-1. Размеры
2 ветви изменяются по "своим" законам, отличным от (2.32) и (2.33).
На всем "мышечном" участке для упрощения вычислений все ветвления в
исходном, золотом режиме гипертензии примем симметричными, т.е. d1(bЗС)=d2(bЗС)=0,794dС(bЗС), l1(bЗС)=l2(bЗС)=0,794lС(bЗС).
Коэффициент конструкции для всех мышечных сосудов в условиях гипертензии СC(b)=С1(b)=С2(b)=3.
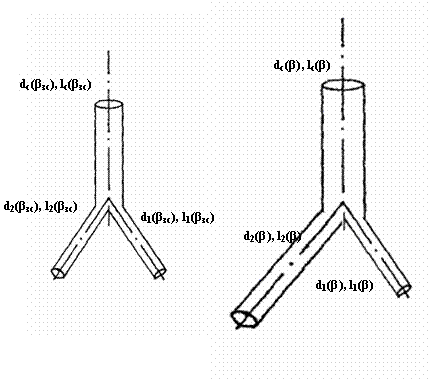
Рис. 9. Переходные тройники в диапазоне гипертензии βЗС<β≤β1.
А – тройник в
золотом режиме, Б – тройник в режиме гипертензии: d1(β)=0,794dС(βЗС), d2(β)=[β-0,5]1/3dС(βЗС), dС(β)=β1/3dС(βЗС), l1(β)=0,794lС(βЗС), l2(β)=[β-0,5]1/3lС(βЗС), lС(β)=β1/3lС(βЗС).
Величина давления, приложенного к стволу
и ветвям, одинакова: ΔP1(bЗС) =ΔP2(bЗС) =ΔPС(bЗС) =3,5 мм рт. ст. В соответствии с этими условиями и
выражением (2.56) кровотоки в стволе, 1 и 2 ветвях при bЗС<b£b1 в каждом переходном тройнике изменяются следующим
образом,
QС(b) = b2QС(bЗС),
Q1(b) = 0,5bQС(bЗС),
Q2(b) = b(b-0,5)QС(bЗС).
Для диапазона гипертензии bn-1<b£bn
QС(b) = b2QС(bЗС), (2.59)
Q1(b) = 0,5bbn-1QС(bЗС), (2.60)
Q2(b) = b(b-0,5bn-1)QС(bЗС), (2.61)
где QC(b), Q1(b), Q2(b) – соответственно
кровотоки в стволе, 1 и 2 ветвях в диапазоне гипертензии bn-1<b£bn.
Исходя из (2.59)-(2.61), структуру
кровотока в стволе и ветвях переходного тройника можно представить следующим
выражением:
b2QС(b) = 0,5bb n-1QС(bЗС) + b(b-0,5b n-1)QС(bЗС).
В соответствии с (2.57) распределение
объема в переходном тройнике для bn-1<b£bn происходит следующим образом:
VС(b) = bVС(bЗС), (2.62)
V1(b) = 0,5b n-1VС(bЗС), (2.63)
V2(b) = (b-0,5b n-1)VС(bЗС), (2.64)
где V(bЗС) -
объем ствола, соответствующий золотому режиму гипертензии; VС(b), V1(b), V2(b) – соответственно
объем ствола, 1 и 2 ветвей в диапазоне гипертензии bn-1<b£bn.
Аналогично, в соответствии с (2.58)
распределение проводимостей в тройнике
GС(b) = bGС(bЗС), (2.65)
G1(b) = 0,5b n-1GС(bЗС), (2.66)
G2(b) = (b-0,5b n-1)GС(bЗС), (2.67)
где GС(bЗС) - проводимость ствола, соответствующая золотому режиму
гипертензии; GС(b), G1(b), G2(b) –проводимость ствола, 1 и 2
ветвей в диапазоне гипертензии bn-1<b£bn.
В режиме "минимальной" работы
диаметры ствола и ветвей в тройнике связаны выражением [Розен, 1969]
d1(b)3 + d2(b)3=dС(b)3.
Исходя из этого выражения и в
соответствии с (2.32)-(2.33) и (2.62)-(2.64) в пределах bn-1£b£bn
диаметры ствола и ветвей
dС(b) = b1/3dС(bЗС), (2.68)
d1(b) = 0,794bn-11/3dС(bЗС), (2.69)
d2(b) = [b-0,5bn-1]1/3dС(bЗС), (2.70)
где dС(bЗС) – диаметр ствола в золотом режиме гипертензии; dС(b), d1(b), d2(b) – диаметр ствола, 1 и 2 ветвей в режиме гипертензии.
Соответственно, поскольку для всех мышечных сосудов l/d=const,
lС(b) = b1/3lС(bЗС), (2.71)
l1(b) = 0,794bn-11/3lС(bЗС), (2.72)
l2(b) = [b-0,5bn-1]1/3lС(bЗС), (2.73)
где lС(bЗС) –длина ствола в золотом режиме гипертензии; lС(b), l1(b), l2(b) – длина ствола, 1 и 2 ветвей в диапазоне bn-1<b£bn.
Мышечные тройники отличаются от эластических
тем, что все их элементы (ствол и ветви) при гипертензии изменяются в различной
степени. Покажем, что оптимальные отношения мощностей (2.44) и (2.45),
соответствующие подобным тройникам, справедливы и для переходных тройников.
В стволе переходного тройника
механическая, химическая и суммарная мощности в режимах гипертензии bn-1<b£bn
изменяются в соответствии с (2.37) и (2.41),
WМС(b) = 0,5b3WМС(bЗС), (2.74)
WХС(b) = 0,5b3WХС(bЗС). (2.75)
Естественно, что суммарная мощность в стволе
WС(b) = b3WС(bЗС). (2.76)
В 1 ветви при гипертензии,
соответствующей bn-1,
механическая мощность увеличивается в bn-13 раз. При
дальнейшем росте гипертензии за счет увеличения ∆P1(bn-1) и Q1(bn-1) в b/bn-1 раз
WМ1(b) =0,5b2bn-1WМС(bЗС). (2.77)
Определим химическую
мощность в 1 ветви. В соответствии с (2.51) и (2.54), время пребывания
эритроцитов в 1 ветви в диапазоне bn-1<b£bn
t1(b) = tС(bЗС)/b.
(2.78)
Несложно показать, что и
t2(b) = tС(bЗС)/b,
tС(b) = tС(bЗС)/b.
Очевидна "временная" аналогия в стволе и
ветвях, принадлежащих к различным генерациям мышечных сосудов. Исходя из (2.24)
и (2.78), потребляемая в этом сосуде удельная химическая энергия за единицу
времени
b1(b) = b2bС(bЗС). (2.79)
В соответствии с
(2.53) и (2.79) химическая мощность в 1 ветви
WХ1(bn-1) =0,5b2bn-1WХС(bЗС). (2.80)
Общая мощность в 1
ветви переходного тройника
W1(b) = b2bn-1WС(bЗС). (2.81)
В 2 ветви
переходного тройника
DP2(b) = bDPс(bЗС),
Q2(b) = 0,5b(b-bn-1)QC(bЗС).
Исходя из этого, механическая мощность в 2
ветви
WМ2(b) = 0,5b2(b-0,5bn-1)WМС(bЗС). (2.82)
В этой же ветви,
b2(b)=b2bС(bЗС),
V2(b) = (b-0,5)VС(bЗС).
Следовательно,
WХ2(b) = b2(b-0,5bn-1)WХС(bЗС). (2.83)
Соответственно, общая мощность, потребляемая во 2
ветви
W2(b) = b2(b-0,5bn-1)WС(bЗС). (2.84)
Суммарная мощность в
1 и 2 ветвях переходного тройника
W(b) = W1(b) + W1(b) = b3WС(bЗС).
(2.85)
Из
анализа выражений (2.77) и (2.80), (2.82) и (2.83) очевидно, что отношение
механической и химической мощностей в стволе и ветвях любого тройника одинаково
и не зависит от уровня гипертензии
WM1(b)/WХ1(b) = WM2(b)/WХ2(b) = WMC(b)/WХC(b) = 0,5. (2.86)
Из анализа выражений
(2.76) и (2.85) следует, что
[W1(b) + W2(b)]/WС(b) =1.
(2.87)
Очевидно, что отношения
(2.86) и (2.87) полностью аналогичны отношениям (2.44) и (2.45). Эта аналогия
указывает на то, что на всем транспортном участке эти отношения одинаковы и
неизменны для всех сосудов, а также подобных и переходных тройников, независимо
от уровня гипертензии. Наличие этих
отношений обусловливает оптимальное вхождение элементов тройников в системы
"Подобный тройник" и "Переходной тройник" при любой
гипертензии, что обеспечивает, в конечном счете, минимальный расход энергии,
крови и сосудистого материала на транспорт единичного объема кислорода в каждой
генерации артериальных сосудов.